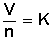LEY DE AVOGADRO
Relación entre la cantidad de gas y su volumen.
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión (La cantidad de gas se mide en moles.)
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas"
que se traduce en que si dividimos el volumen de un gas por el número de moles que lo conforman obtendremos un valor constante.
V: volumen del gas
n: número de moles
K: constante
El volumen es directamente proporcional a la cantidad de gas:
- Si aumentamos la cantidad de gas, aumentará el volumen.
- Si disminuimos la cantidad de gas, el volumen disminuye.
Ley de Boyle
Relación entre la presión y el volumen de un gas cuando la temperatura es constante.
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
 Si consideramos una cantidad dada de gas y aumentamos la presión (manteniendo constante la temperatura), su volumen disminuye. Si por el contrario disminuimos la presión, su volumen aumenta.
Si consideramos una cantidad dada de gas y aumentamos la presión (manteniendo constante la temperatura), su volumen disminuye. Si por el contrario disminuimos la presión, su volumen aumenta.
P y V son magnitudes inversamente proporcionales. Esto es, su producto permanece invariable.
P: presión
V: volumen
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
Ley de Charles
Relación entre la temperatura y el volumen de un gas cuando la presión es constante.
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
 Si consideramos una cantidad dada de gas y aumentamos su temperatura (manteniendo constante la presión), su volumen aumenta. Si por el contrario disminuimos la temperatura, su volumen disminuye.
Si consideramos una cantidad dada de gas y aumentamos su temperatura (manteniendo constante la presión), su volumen aumenta. Si por el contrario disminuimos la temperatura, su volumen disminuye.
V y T son directamente proporcionales. Esto es, el cociente de valores correspondientes de V y T, permanece invariable.
T: temperatura
V: volumen
El volumen es directamente proporcional a la temperatura del gas:
- Si la temperatura aumenta, el volumen del gas aumenta.
- Si la temperatura del gas disminuye, el volumen disminuye.
Ley de Gay-Lussac
Relación entre la presión y la temperatura de un gas cuando el volumen es constante.
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
 Si consideramos una cantidad dada de gas y aumentamos su temperatura (manteniendo constante el volumen), su presión aumenta. Si por el contrario disminuimos la temperatura, su presión disminuye.
Si consideramos una cantidad dada de gas y aumentamos su temperatura (manteniendo constante el volumen), su presión aumenta. Si por el contrario disminuimos la temperatura, su presión disminuye.
P y T son directamente proporcionales. Esto es, el cociente de valores correspondientes de P y T, permanece invariable.
P: presión
T: temperatura
La presión del gas es directamente proporcional a su temperatura:
- Si aumentamos la temperatura, aumentará la presión.
- Si disminuimos la temperatura, disminuirá la presión.